г. Минск, 220 073, ул. Скрыганова, 14, помещение номер 23
info@ilpa-tech.ru
Беларусь
+375 (29) 626-19-06
г. Минск, 220 073, ул. Скрыганова, 14, помещение номер 23
info@ilpa-tech.ru
Беларусь
+375 (29) 626-19-06
Элементы с одинаковыми электродами, или симметричные элементы, используются для изучения поведения электродов аккумуляторной батареи, для изучения реакций при вставке и для определения полного сопротивления положительных и отрицательных электродов в батареях. Они также используются для изучения электродов литиевых аккумуляторов.
Симметричные ячейки состоят из двух идентичных электродов, на которых протекают окислительно-восстановительные реакции, разделенных жидким или твердым ионным проводником, по которому заряды переносятся ионным путем. Основное преимущество использования симметричных элементов заключается в том, что исследуются два одинаковых интерфейса, в то время как в полных элементах или даже в полуэлементах используются два разных интерфейса.
В аккумуляторах электроды представляют собой сложные соединения, состоящие из множества различных химических веществ: активных материалов, связующих, электронных проводников и так далее…
Симметричные ячейки позволяют нам понять взаимодействие и электрохимическую стабильность каждого из этих соединений при окислении и восстановлении с данным электролитом или электродом.
Здесь мы рассмотрим случай, когда изучается взаимодействие электролита с металлическим литием, а точнее его электрохимическая стабильность.
Рассмотрим симметричный элемент, состоящий из двух литиевых электродов, разделенных электролитом, содержащим катион Li+. Разность напряжений на элементе равна 0.
При подаче положительного тока (I>0) один из электродов становится анодом, и на его границе раздела происходит следующая реакция окисления:
![]()
Другой электрод становится катодом, и на его границе раздела происходит следующая реакция восстановления:
![]()
При подаче отрицательного тока (I<0) роли каждого электрода меняются местами: бывший катод становится анодом, а бывший анод становится катодом.
На рисунке 1 показан потенциальный отклик симметричной ячейки Li (рисунок 1b) на положительные и отрицательные значения тока (рисунок 1a). Согласно Барду и Фолкнеру, τ1 называется постоянной времени перехода, после истечения которого “поток Θ к поверхности электрода (в случае реакции восстановления) [...] становится недостаточно большим, чтобы удовлетворить приложенный ток, и потенциал смещается к более экстремальному значению, при котором может произойти другой электродный процесс”.
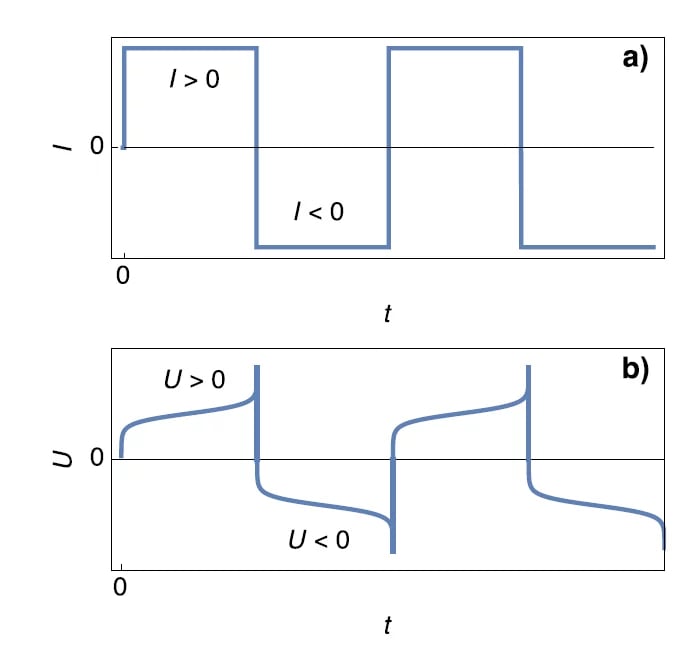
Рисунок 1: Схема а) изменения гальваностатического тока и б) характеристики напряжения для симметричного литий-Литий элемента. U=E1−E2.
В случае I>0 быстрое увеличение потенциала при t=τ1 может соответствовать полному расходу литиевого электрода. Это показано на рисунке 2.
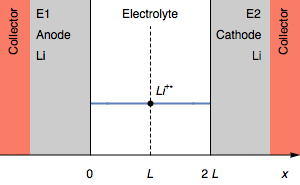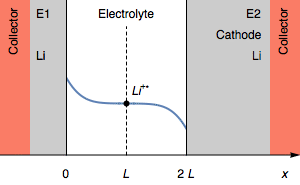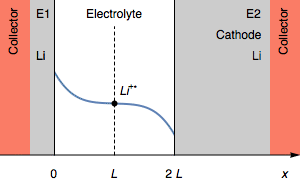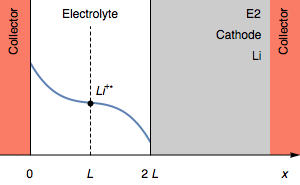
Рисунок 2: Изменение профиля концентрации и электродов симметричного элемента при переходе из-за полного окисления анода.
На рисунке 2 толщина литиевого анода равна 0 во время перехода. Дальнейшим процессом окисления может быть окисление токосъемника. В начальном состоянии E1=E2, а затем E1>E2. Мы также имеем E1−E2=U, как показано на рисунке 1.
Тем не менее, в случае, когда I>0, быстрое увеличение потенциала также может соответствовать полному истощению Li+ (CLi+=0) на границе раздела электролит|Li на катоде. Это показано на рисунке 3.
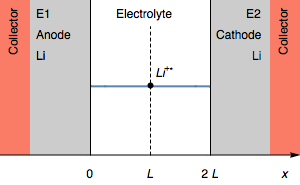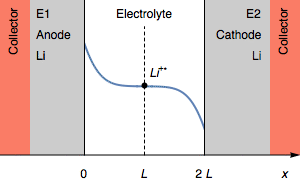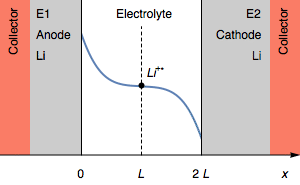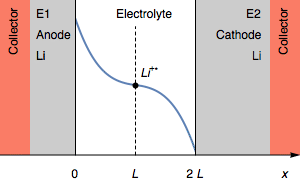
Рисунок 3: Изменение профиля концентрации и симметричности электродов при переходе из-за истощения межфазного катиона Li+.
Концентрация Li+ на границе раздела фаз на катоде падает до 0. Дальнейшим процессом восстановления может быть восстановление растворителя. В начальном состоянии E1=E2 и затем E1>E2. Мы также имеем E1−E2=U, как показано на рисунке 1.
В случае I<0 на карту поставлены те же явления, но роль электродов меняется. В начальном состоянии, когда E1=E2, а затем E1<E2, электрод 2 становится анодом, а электрод 1 становится катодом.
Симметричные ячейки являются простым и практичным способом проверки стабильности электродов при гальваностатическом циклировании. В случае Li окисление может привести к разрушению поверхности, а осаждение металла (восстановление Li+) может привести к образованию дендритов. На рисунке 4a показана характеристика напряжения стабильного элемента и стабильных электродов, где амплитуды напряжения не меняются со временем, а на рисунке 4b показана характеристика напряжения нестабильного элемента, состоящего из нестабильных электродов, где амплитуды потенциала меняются со временем.
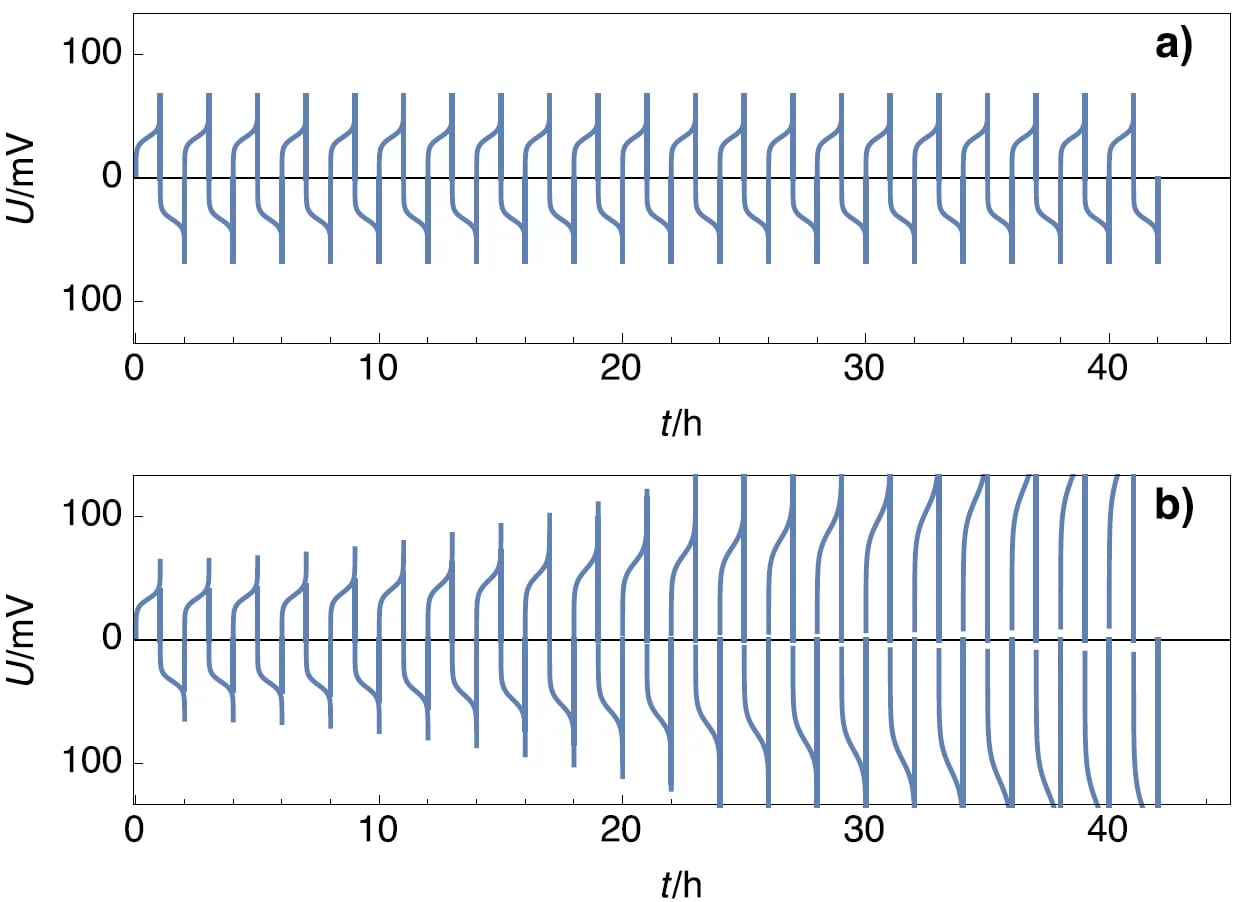
Рисунок 4: Схема профилей потенциалов для а) стабильных электродов и б) нестабильного электрода.
Предполагая, что окисление анода происходит с помощью процесса, показанного в уравнении (1), время перехода τ зависит только от массы электрода mLi, которая определяет заряд, необходимый для полного окисления анода, и приложенного тока. Если мы определим заряд и ток по единице площади, Q и i, соответственно, то получим:
![]()
Заменив количество электронов Q на единицу площади на количество Li на единицу площади, мы получим:
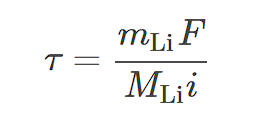
Где MLi − атомная масса Li (MLi=6,94г/моль-1), а F - постоянная Фарадея.
Предполагая, что восстановление Li+ происходит с помощью процесса, показанного в уравнении (2), время перехода τ теперь можно рассчитать по уравнению Сэнда:

Где C∗Li+ и DLi+ - объемная концентрация и коэффициент диффузии Li+ в электролите соответственно.
Знание того, как плотность тока влияет на время перехода, позволяет нам лучше понять, какой механизм отвечает за увеличение/уменьшение потенциала, определяющее время перехода.
На рисунке 5 показано изменение напряжения в зависимости от времени для гальваностатических значений плотности тока противоположного знака, выполненных при трех различных значениях, на симметричном элементе Li|Li.
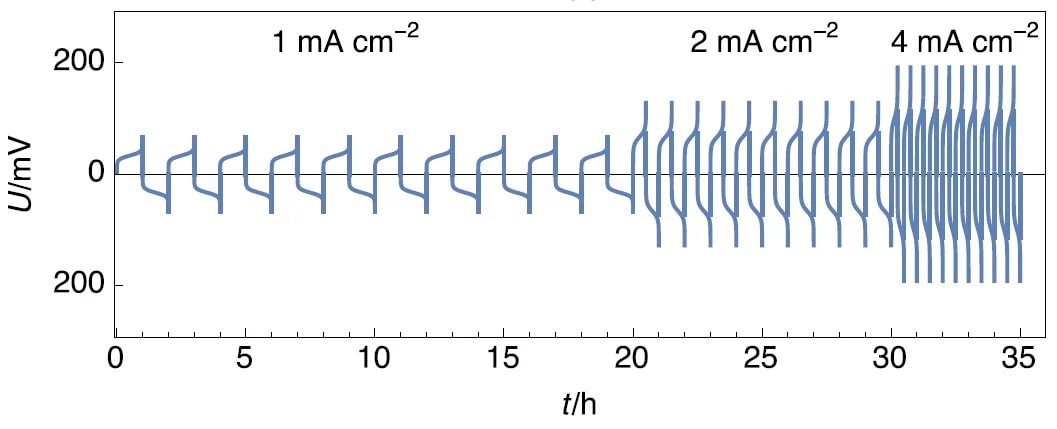
Рисунок 5: Хронопотенциометрия, выполненная с увеличением плотности тока, адаптирована по рисунку 3 в.
Можно видеть, что при умножении плотности тока на 2 время перехода в обоих направлениях тока делится на 2. Это показывает, что уравнения (3-4) могут быть использованы для описания зависимости времени перехода от времени и что регулирующим механизмом является общее окисление Li.
Симметричные ячейки могут быть эффективно использованы для изучения и тестирования стабильности литиевых электродов при контакте с твердыми электролитами и способности этих электролитов предотвращать образование дендритов. Используя два идентичных электрода, можно легко изучить анодное и катодное поведение с течением времени и количество циклов взаимодействия одного электрода с электролитом без использования электрода сравнения. Однако для дальнейшего изучения механизмов деградации рекомендуется использовать трехэлектродную конфигурацию.
г. Минск, 220 073, ул. Скрыганова, 14,
помещение номер 23
+375 (29) 626-19-06
info@ilpa-tech.ru